目次
電池のしくみ
ボルタの電池
図のように亜鉛板(Zn)と銅板(Cu)を希硫酸(H2SO4)にひたし両者を導線でつなぎます。
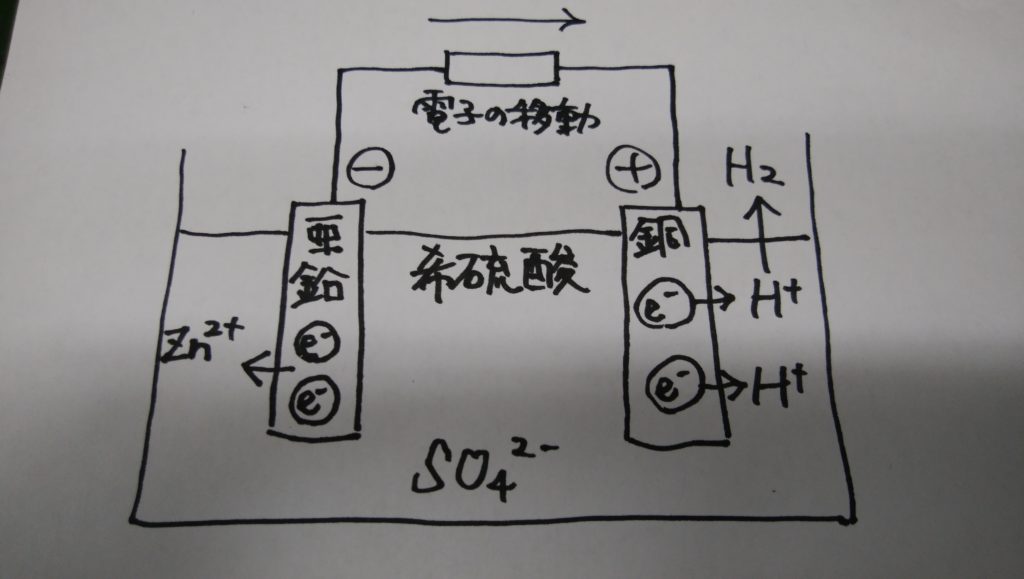
すると亜鉛板から亜鉛が亜鉛イオン(Zn2+)となって少しずつ希硫酸のなかに溶け出していきます。
亜鉛イオンは亜鉛の原子が電子の一部を失ったものなのでプラス電荷をもっています。
一方亜鉛板上には亜鉛イオンが溶けた後の電子がのこります。
Zn(亜鉛) ⇒ Zn2+(亜鉛イオン) + 2e-(電子)
亜鉛板に残った電子は導線を伝わって銅版側に集まり、溶解液中の水素イオンH+と反応して水素となります。
2H+(水素イオン) + 2e-(電子) ⇒ H2(水素)
この結果銅板をプラス(正極)、亜鉛板をマイナス(負極)とする電流が導線に流れます。これが電池の原理で発見者にちなんで「ボルタの電池」とよばれています。
分極作用とルクランシェ電池
ボルタの電池では水素イオンと電子が結合したけっか銅版側に水素ガスが生じます。この水素ガスはしばらくすると銅版の表面をすっかりおおってしまい、水素イオンが近づくのを妨げます。
この現象を「分極作用」といいます。ボルタの電池にはこの分極作用があるためすぐに電圧が低下して使えなくなってしまう欠点がありました。
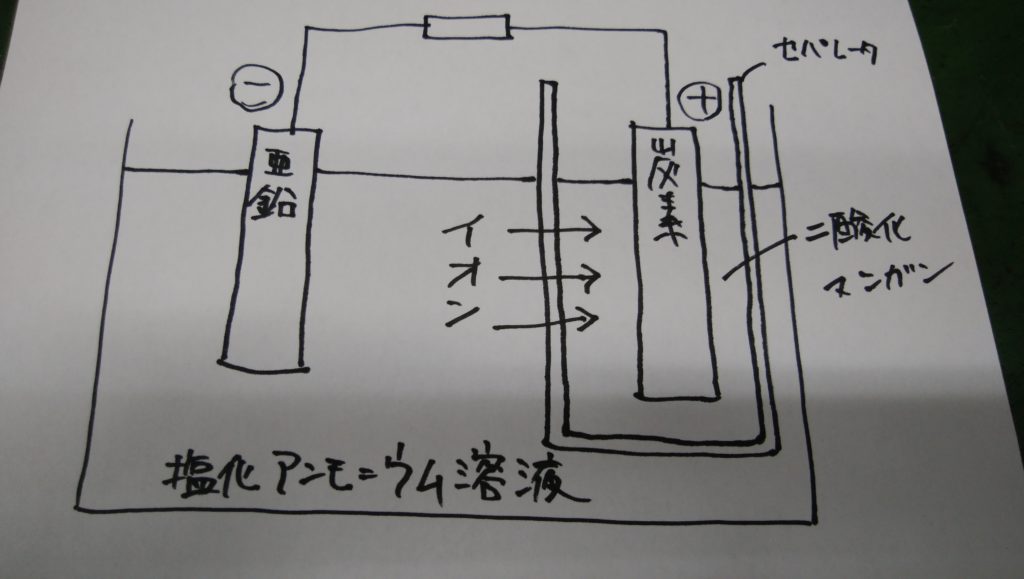
そこで正極と負極の間を下図のように「セパレータ」で仕切り、正極の周囲に「二酸化マンガン」MnO2を置いた電池が考案されました。
二酸化マンガンンは次のような正極で発生する水素ガスを水H2Oに変え、分極作用を防止します。
2H+(水素イオン) + 2MnO2(二酸化マンガン) ⇒ Mn2O3 + H2O(水)
この電池は現在使われている乾電池の原型となったもので、発明者にちなんで「ルクランシェ電池」と呼ばれます。
電池の構成要素
以上のように電池は亜鉛、塩化アンモニウム溶液、二酸化マンガンといった物質の組み合わせで出来ています。
これらはそれぞれ「負極活物質」「電解液」「正極活物質」とよばれています。この3つの物質を次のように配列したものが電池の基本的な構造になります。
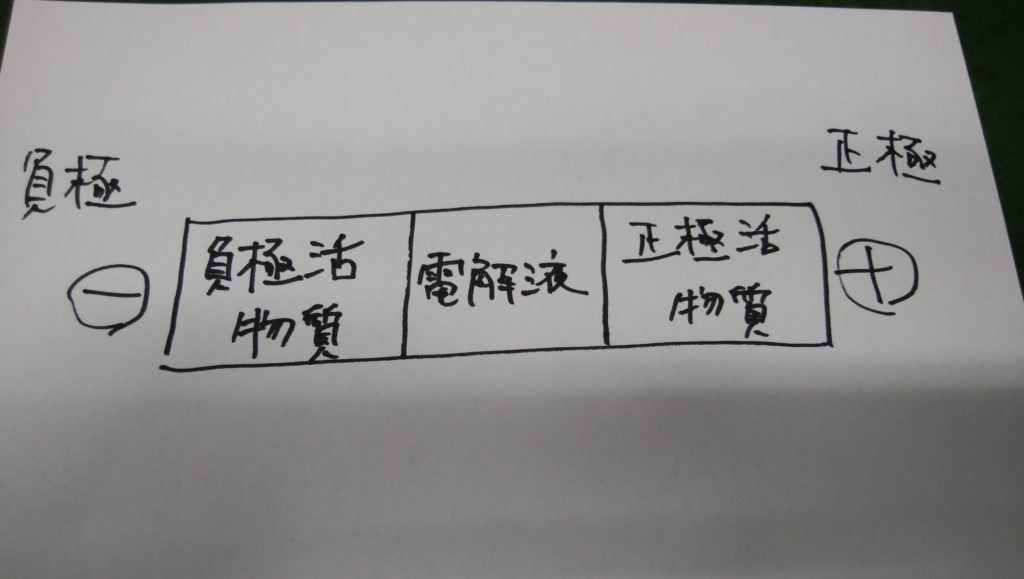
負極活物質
負極に使われる材料(亜鉛など)。陽イオンとなって電解液に溶け出し、負極側に電子を生じます。
電解液
イオンの移動によって電気を伝える物質(希硫酸、塩化ナトリウムなど)を「電解質」といい、電解質の溶液を電解液といいます。
正極活物質
正極で生じる「分極作用」を防止するための物質(二酸化マンガンなど)。
一次電池と二次電池
電池は大まかに一次電池と二次電池、燃料電池の3種類に分類できます。
一次電池
⇒1度放電させると使えなくなってしまう電池。
二次電池
⇒充電すれば何度でも使用できる電池(蓄電池)。
燃料電池
⇒燃料と酸素を外部から供給する電池。
一次電池の種類と特徴
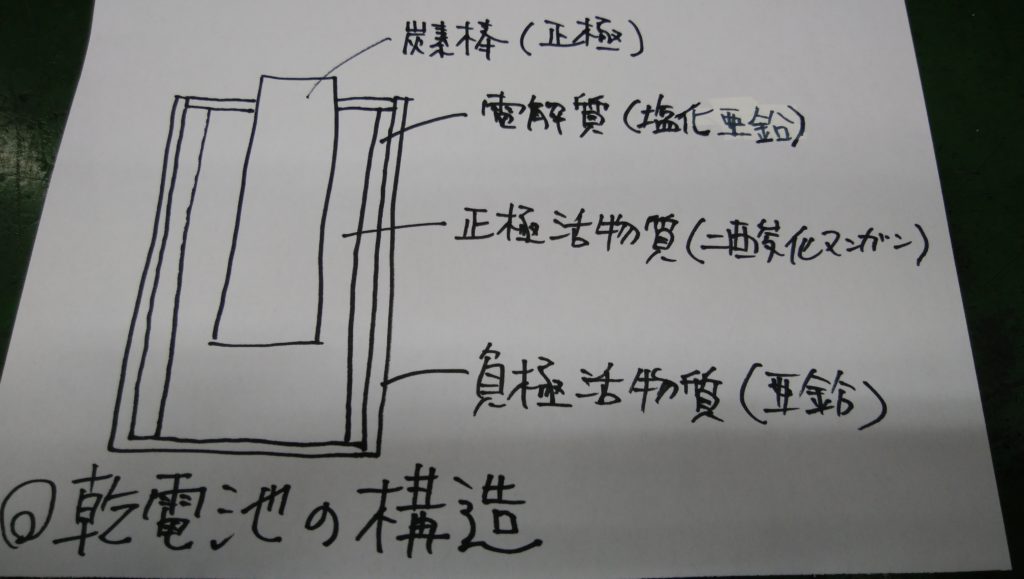
一次電池の原型はルクランシェ電池です。ただし現在では電解液をのり状にして扱いやすくした「乾電池」が一般的に使われています。
一次電池には負極や正極活物質、電解液に用いられている材質によって名称が付けられています。主な電池には以下の種類があります。
マンガン乾電池
正極活物質に二酸化マンガンMnO2,負極活物質に亜鉛Znを用いた乾電池。電解質には塩化亜鉛や塩化アンモニウムが用いられます。
アルカリ乾電池
負極活物質や正極活物質はマンガン乾電池と同じ、電解液としてアルカリ性の水酸化カリウムなどを使用したもの。マンガン乾電池より大電流で使えます。
リチウム電池
負極活物質にリチウムを用いる乾電池。端子電圧が3Vと高いのが特徴です。
空気電池
正極活物質として空気中の酸素を利用する電池。乾電池と湿電池があります。
水銀電池
正極活物質として酸化水銀を用いたもの。環境問題から現在では生産中止になっています。
二次電池の種類と特徴
一度放電しても充電すると再び使用できるようになる電池を二次電池といいます。
二次電池には「鉛蓄電池」「アルカリ蓄電池」「リチウムイオン電池」などの種類があります。
鉛蓄電池
特徴:自動車用に普及、経済的
電圧:2.0V
アルカリ蓄電池
特徴:小型で長寿命
電圧:12V~1.3V
リチウムイオン電池
特徴:高電圧、高エネルギー密度
電圧:2V~3V
鉛蓄電池
鉛蓄電池は図のように負極活物質として鉛(Pb)、正極活物質として二酸化鉛(PbO2)を用い、電解液の希硫酸(H2SO4)のなかに入れたものです。
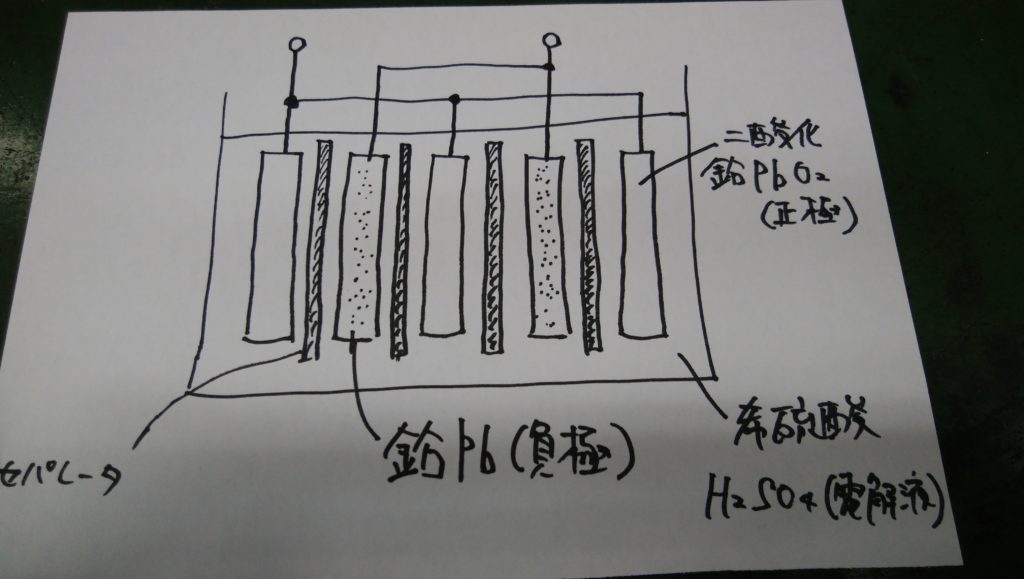
放電時には両極はともに希硫酸と反応し硫酸鉛(PbSO4)となります。一方充電時には放電と逆の反応が起こります。
PbO2(正極) + 2H2SO4(電解液) + Pb(負極)
PbSO4(正極) + 2H2O(電解液) + PbSO4(負極)
アルカリ蓄電池
アルカリ蓄電池は電解液に水酸化カリウムを用いる二次電池です。
負極活物質によって「ニッケルカドミウム蓄電池」(ニッカド電池)、「ニッケル水素電池」などの種類があります。
ニッケルカドミウム電池(ニッカド電池)
正極にニッケル酸化物、負極にカドミウムを用いたもの。
2NiOOH(正極) + 2H2O + Cd(負極)
2Ni(OH)2(正極) + Cd(OH)2(負極)
ニッケル水素電池
正極にニッケル酸化物、負極に水素吸蔵合金を用いたもの。ニッケルカドミウム電池の約2倍の容量があります。
2NiOOH(正極) + MH2(負極)
放電 ↓
2Ni(OH)2 + M
※Mは水素吸蔵合金を表します。
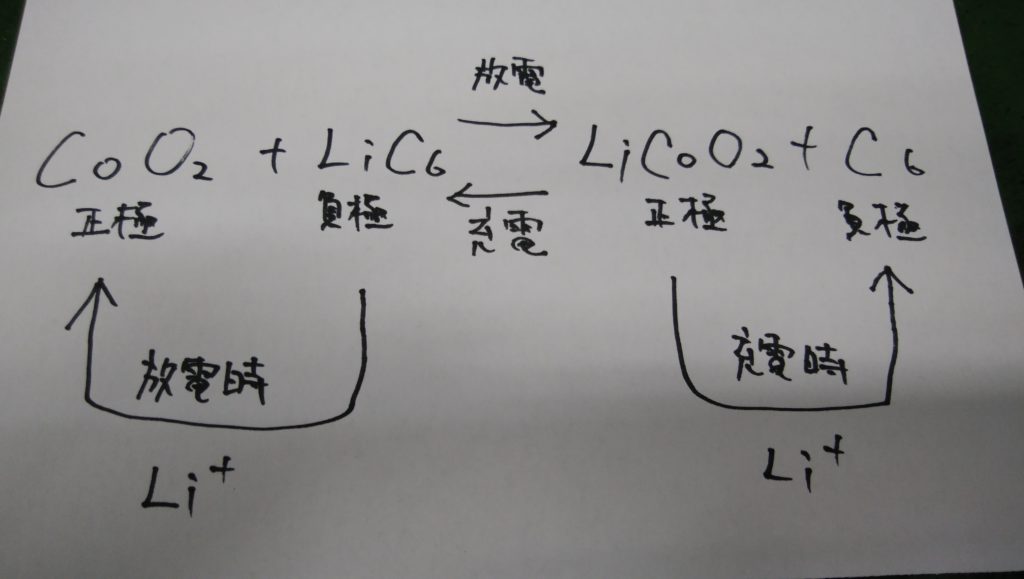
リチウムイオン電池
正極にコバルト酸リチウム、負極に黒鉛、電解液に有機電界液を用いたもの。
放電時には負極から正極へリチウムイオン(Li+)が移動し、充電時には逆になります。
電気分解とファラデーの法則
電解質ってなんだ
電荷を帯びた原子を「イオン」といいます。たとえば食塩(NaCl)を水に溶かすと+の電荷をもったナトリウムイオンNa+と-の電荷をもった塩素イオンCl-に分離します。
このように水に溶かすとイオンに分離する物質を「電解質」といい電解質の溶液を「電解液」といいます。
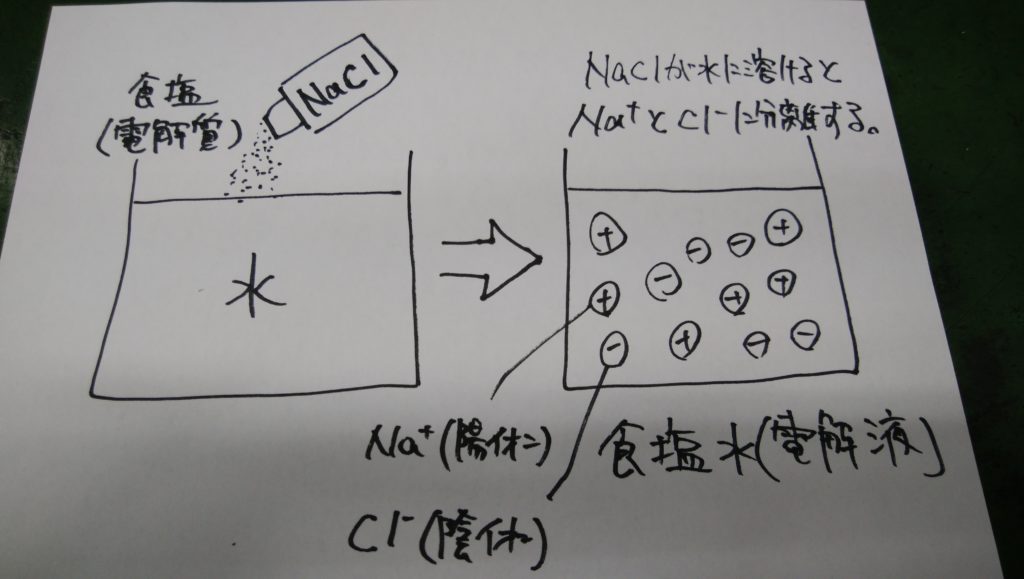
プラスの電荷をもつイオンを「陽イオン」、マイナスの電荷をもつイオンを「陰イオン」といいます。
電解液のなかに電極を入れて電極をつなぐと陽イオンは陰極(-)へ、陰イオンは陽極(+)へ引き寄せられるので電流が流れます。
食塩水は電気を通しますが砂糖水やアルコール水は電気を通しません。これは砂糖やアルコールは水に溶かしてもイオンに分離しないためです。このような物質を非電解物質といいます。
電解質:食塩(塩化ナトリウム)、硫酸、塩酸など
非電解質:砂糖、アルコール、水銀など
電気分解とは
イオンは原子から電子が抜き取られたり、余分にくっついたりしてできたものです。
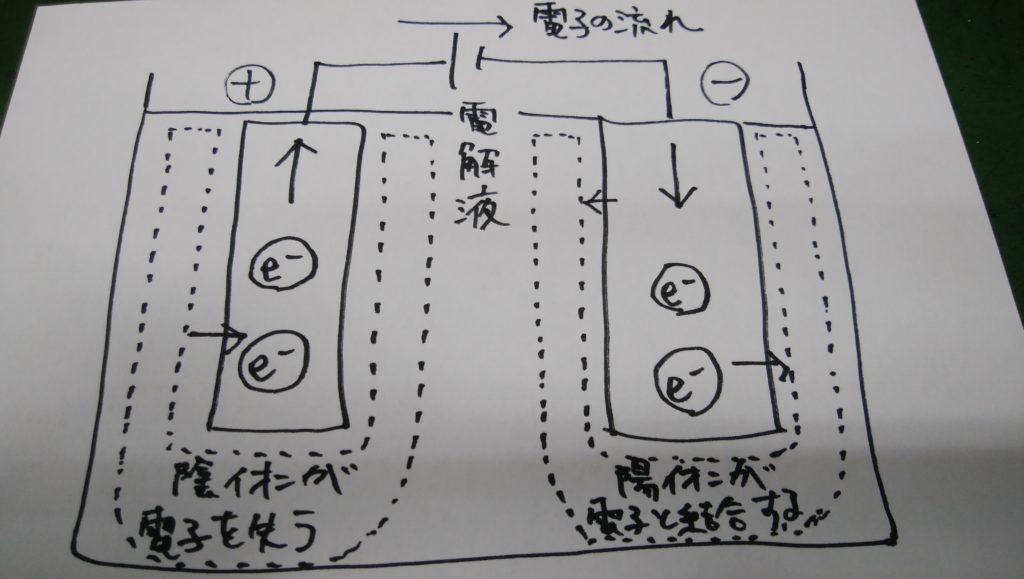
そのため電解液のなかに電極を入れて電流を流すと、陽極と陰極の周囲で次のような化学反応が起こります。
陽極:引き寄せられた陰イオンが電子を放出する
陰極:引き寄せられた陽イオンが電子と結合する
この結果電極の周囲には何らかの物質が析出します。この一連の操作を「電気分解」といいます。
たとえば塩酸(HCl)溶液を電気分解すると両極ではそれぞれ次のような反応が起こります。
陽極:塩素イオンCl-が電子を失って塩素原子になり、2個結合して塩素分子Cl2を析出。
2Cl-(塩素イオン) ⇒ Cl2(塩素) + 2e-(電子)
陰極:水素イオンH+が電子と結合して水素原子になり、2個結合して水素分子H2を析出。
2H+(水素イオン) + 2e-(電子) ⇒ H2(水素)

電気分解は次のような工業分野で利用されています。
化学物質の製造
苛性ソーダ(NaOH)、塩素(Cl)、などを電気分解で析出する。
金属の電解精錬
不純物を含む金属を水溶液から電気分解によって析出する(銅、亜鉛、ニッケルなど)。
溶融塩電解
金属化合物を高温で溶かして電気分解し金属だけを取り出す(アルミニウム、マグネシウムなど)。
電気めっき
下地にする金属を陰極にしてめっきする金属(金、銀、クロムなど)を析出させる。
ファラデーの法則
電気分解によって析出される物質の量に関しては次のような「ファラデーの法則」が成り立ちます。
第一法則:電極に析出される物質の量は、電解液中を通過した総「電気量」に比例する。
第二法則:電気量が同一の場合、析出される物質の量は、その物質の「電気化学当量」に比例する。
ファラデーの法則により、電気分解で析出される物質ぼ量(g)は次式で求められます。
ω = kQ(g)
ω=析出される物質の量(g)
k=物質の電気化学当量(g/(A・h))
Q=電気量(A・h)
ファラデーの法則で使われている電気量と電気化学当量について説明しておきましょう。
電気量について
電気量Qは、電解液中のイオンが運ぶ電荷の総量です。1Aの電流が1秒間に運ぶ電荷の量は1Cですから、電気量Qは電流と通過時間の積で求められます。
電気量Q=電流×通過時間(A・h)
通過時間の単位は時間(h)の場合が多いので電気量の単位にはクーロン(C)の代わりにアンペア時(A・h)がよく用いられます。
電気化学当量について
電気化学当量kは、1A・hの電気量で析出される物質の量を表し、一般に次のように求めることができます。
たとえば塩素Clは、中性の状態では17個の電子をもちますが、水に溶かすと電子1個をもらって塩素イオンCl-になります。このため塩素イオン1個は電子1個分の電荷をもちます。このことを「塩素の原子価は1である」といいます。
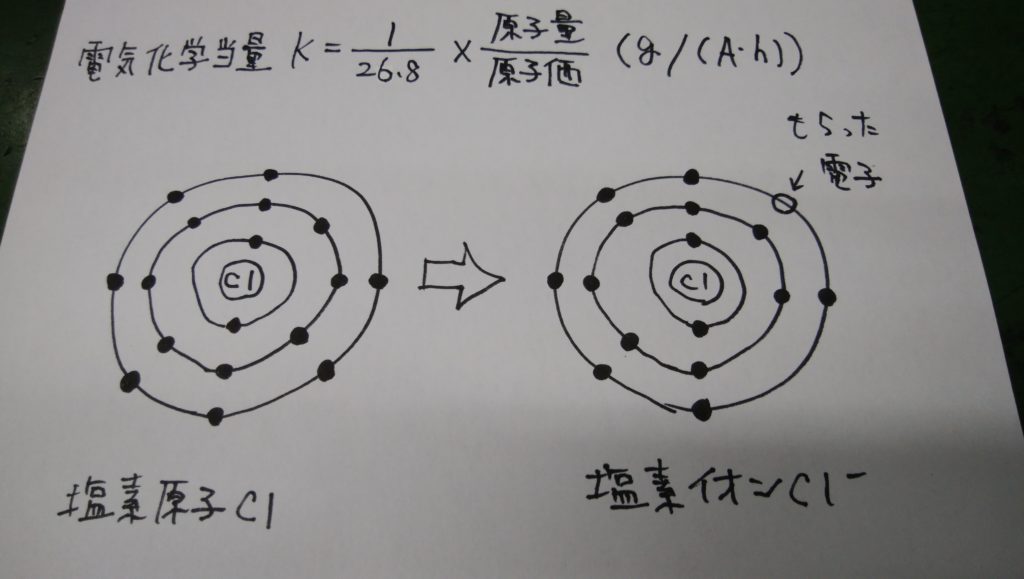
電子1個分の電荷は約1.602×10-^19Cなので、塩素イオン6.02×10^23個分(1モルの原子数)の電荷は次のように計算できます。
6.02×10^23(1モルの原子数)×1.602×10-^19(電子1個の電荷)=約96500(C/mol)
この値を「ファラデー定数」といいます。単位(C/mol)を(A・h/mol)に換算すると、ファラデー定数は26.8(A・h/mol)とも表せます。
塩酸を電気分解すると、塩素イオンは陽極から出る電子と結合して塩素になります。塩素の原子価は1なので、イオン1個につき1個の電子が結合します。したがってファラデー定数より、1モルの塩素を析出するには26.8A・hの電気量が必要になります。言い換えると、1A・hの電気量では1/26.8モル分の塩素が析出されます。
原子1モルが何グラムになるかを表す数値を「原子量」といいます。塩素の原子量は約35.5なので、1/26.8モル分の塩素の質量(電気化学当量)は、次のように計算できます。
1/26.8 × 35.5 = 1.32(g/(A・h))


